- Главная
- >
- Роботы с искусственным интеллектом
- >
- Исследователи NIH совместно с NIST используют искусственный интеллект для контроля качества тканей полученных из стволовых клеток
Исследователи NIH совместно с NIST используют искусственный интеллект для контроля качества тканей полученных из стволовых клеток
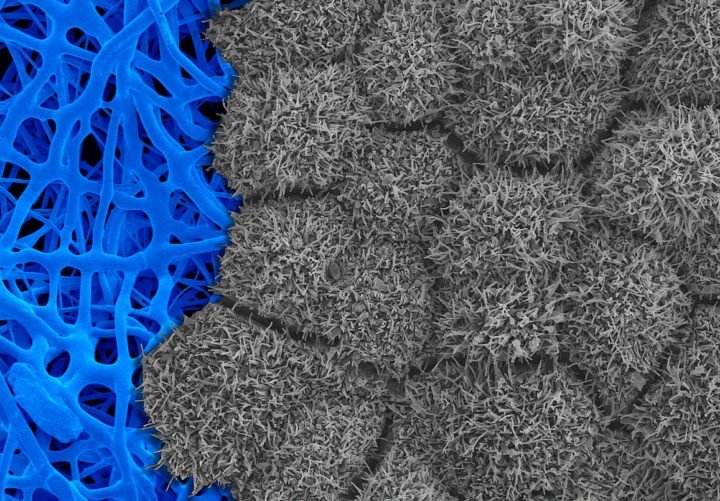
Исследователи использовали искусственный интеллект (ИИ) для оценки «пятен» пигментного эпителия сетчатки (RPE), полученных из стволовых клеток, для имплантации в глаза пациентов с возрастной дегенерацией желтого пятна (AMD), ведущей причиной слепоты.
Проверенное принципом исследование помогает проложить путь для контроля качества терапевтических клеток и тканей на основе искусственного интеллекта. Метод был разработан исследователями из Национального института глаз (NEI) и Национального института стандартов и технологий (NIST) и описан в отчете, опубликованном в Интернете в журнале клинических исследований. NEI является частью Национального института здоровья.
Немного о новом методе
«Этот основанный на искусственном интеллекте метод проверки тканей, полученных из стволовых клеток, является значительным улучшением по сравнению с традиционными анализами, которые являются низкокачественными, дорогостоящими и требуют обученного пользователя», - сказал Капил Бхарти, доктор философии, старший исследователь в NEI.
Секция трансляционных исследований глазных и стволовых клеток. «Наш подход поможет увеличить производство и ускорить доставку тканей в больницы», - добавил Бхарти, который возглавлял исследование вместе с доктором философии Карлом Саймоном-младшим и доктором философии Питером Байси из NIST. Клетки RPE питают светочувствительные фоторецепторы в глазу и одними из первых умирают от географической атрофии, обычно называемой «сухой» AMD. Фоторецепторы умирают без RPE, что приводит к потере зрения и, следовательно, слепоте.
Команда Bharti работает над техникой изготовления патчей для замены RPE из собственных клеток пациентов с AMD. Клетки крови пациента преобразуются в индуцированные плюрипотентные стволовые клетки (IPSC), которые могут стать клетками любого типа в организме.
Затем клетки IPS высевают на биоразлагаемый каркас, где те должны превратиться в готовые RPE. «Пластырь» RPE скаффолда имплантируется в задней части глаза, за сетчаткой, чтобы спасти фоторецепторы и сохранить зрение. Пластырь успешно сохранил зрение испытаниях на животных, и теперь планируется проведение клинических испытаний с людьми.
Как работает система проверки
В методе проверки, основанном на ИИ, исследователи использовали глубокие нейронные сети, технику ИИ, которая выполняет математические вычисления, направленные на обнаружение закономерностей в немаркированных и неструктурированных данных. Алгоритм оперировал изображениями RPE, полученными с помощью количественной абсорбционной микроскопии в ярких полях.
Сети были обучены идентифицировать визуальные признаки созревания RPE, которые коррелировали с положительной функцией RPE. Затем эти одноклеточные визуальные характеристики были включены в традиционные алгоритмы машинного обучения, которые, в свою очередь, помогли компьютерам научиться обнаруживать дискретные клеточные особенности, имеющие решающее значение для прогнозирования функции ткани RPE.
Тестирование системы
Метод был подтвержден с использованием RPE, полученного из стволовых клеток от здорового донора. Затем его эффективность была проверена путем сравнения iPSC-RPE, полученного от здоровых доноров, с iPSC-RPE от доноров с нарушением глазного альбинизма и с RPE, полученным из стволовых клеток клинического уровня, от доноров с AMD.
В частности, метод анализа изображений на основе AI точно обнаружил известные маркеры зрелости и функции RPE: транс эпителиальную резистентность, меру соединений между соседними RPE и секрецию эндотелиальных факторов роста. Этот метод также может сопоставить конкретный образец ткани iPSC-RPE с другими образцами от того же донора, что помогает подтвердить идентичность тканей во время изготовления образцов клинического качества.
«Множество методов искусственного интеллекта и современное оборудование позволили нам анализировать терабайты данных визуализации для каждого отдельного пациента и делать это более точно и намного быстрее, чем в прошлом», - сказал Байси. «Эта работа демонстрирует, как обычный микроскоп при правильном использовании может обеспечить точное воспроизводимое измерение качества ткани», - сказал Саймон.
Работа была поддержана Программой внутри вузовских исследований NEI и получила Премиюот Общего фонда терапии. Центр проточной цитометрии, возглавляемый Национальным институтом сердца, легких и крови, также внес свой вклад в исследование.
Похожие статьи:

 Учим компьютеры думать как ученые
Учим компьютеры думать как ученые

 Робот BINA48 с ИИ посещает в колледже курсы о любви
Робот BINA48 с ИИ посещает в колледже курсы о любви

 ИИ Baidu может выполнять синхронный перевод между любыми языками
ИИ Baidu может выполнять синхронный перевод между любыми языками

 Fujitsu разрабатывает технологию Content-Aware Computing для ускорения обработки ИИ
Fujitsu разрабатывает технологию Content-Aware Computing для ускорения обработки ИИ

 Отчет 10 самых инновационных компаний в мире об использовании ИИ
Отчет 10 самых инновационных компаний в мире об использовании ИИ
 Принимает участие в иммунотерапии искусственный интеллект
Принимает участие в иммунотерапии искусственный интеллект








